初中化学笔记
U0 绪言 化学使世界变得更加绚丽多彩¶
一、\(化学\xrightarrow {研究} 物质\left\{ \begin{aligned} 性\ \ \ \ \ \ \ 质\\ 结\ \ \ \ \ \ \ 构\\ 组\ \ \ \ \ \ \ 成\\ 变化规律\end{aligned} \right.\)
二、化学史
- 古代化学
- 近代化学:道尔顿《原子论》、阿伏加德罗。
- 现代化学:绿色化学。
三、元素周期表前20位
| 1 氢 \(H\) | 2 氦 \(He\) | 3 锂 \(Li\) | 4 铍 \(Be\) | 5 硼 \(B\) |
|---|---|---|---|---|
| 6 碳 \(C\) | 7 氮 \(N\) | 8 氧 \(O\) | 9 氟 \(F\) | 10 氖 \(Ne\) |
| 11 钠 \(Na\) | 12 镁 \(Mg\) | 13 铝 \(Al\) | 14 硅 \(Si\) | 15 磷 \(P\) |
| 16 硫 \(S\) | 17 氯 \(Cl\) | 18 氩 \(Ar\) | 19 钾 \(K\) | 20 钙 \(Ca\) |
U1 走进化学世界¶
U1-1 物质的变化和性质¶
U1-1-1 化学变化和物理变化¶
一、物理变化:无新物质生成
特点:固液气三态的变化或形状改变
二、化学变化:有新物质生成
有新物质生成通常表现为:颜色变化、放出气体、生成沉淀等。
化学变化还伴随能量变化:吸热(外部温度变低)、放热(外部温度变高)、发光等。
注意
-
发生化学变化时一定会伴随物理变化,发生物理变化时不一定有化学变化。
-
爆炸可能是物理变化,也可能是化学变化。根本区别是看有无新物质生成。
-
燃烧、变质、腐烂等都属于化学变化。

实验1-1
-
物理变化,水蒸气液化形成小水珠。
-
物理变化,硫酸铜晶体(\(CuSO_4·5H_2O\))(别称蓝矾、胆矾、五水硫酸铜)
-
化学变化,硫酸铜溶液和氢氧化钠溶液反应产生蓝色的氢氧化铜(\(Cu(OH)_2\))絮状沉淀
-
化学变化,石灰石和稀盐酸反应产生二氧化碳(\(CO_2\))气体,通入澄清石灰水中后,澄清石灰水变浑浊
U1-1-2 物理性质和化学性质¶
三、物理性质
物质不需要发生化学变化就表现出来的性质叫做物理性质(颜色、状态、气味、硬度、熔点、沸点、密度、溶解性、挥发性、导电性、导热性、吸附性、潮解性、吸水性等)。
四、化学性质
物质需要在化学变化中表现出来的性质叫做化学性质(毒性、可燃性、助燃性、稳定性、氧化性、还原性、酸性、碱性、腐蚀性、脱水性等)。
五、变化与性质
变化:动态过程
性质:固有属性(能、可、易、会、性)
六、性质与用途的关系
性质决定用途,用途反映性质
实验1-2:氧气、二氧化碳的鉴别
(1)燃着的小木条 
操作:将燃着的小木条放入两种气体中
现象:
-
燃着的木条在氧气瓶中燃烧得更剧烈
-
燃着的木条在二氧化碳瓶中熄灭
(2)澄清石灰水
操作:将澄清石灰水倒入两种气体中
现象:
-
澄清石灰水在氧气瓶中仍清澈
-
澄清石灰水在二氧化碳瓶中变浑浊
U1-2 化学是一门以实验为基础的科学¶
一、描述实验:
-
方法:操作-现象-结论
-
描述实验现象时不能出现生成物的名称。
二、雾和烟的区别
-
雾:液体小液滴
-
烟:固体小颗粒
U1-2-1 对蜡烛及其燃烧的探究¶
三、蜡烛燃烧实验表达式🕯️:
\(石蜡+氧气 \xrightarrow {点燃} 二氧化碳+水\)
四、化学学习的特点
-
关注物质的性质
-
关注物质的变化
-
关注物质变化的过程以及对结果的解释和讨论
U1-2-2 对人体吸入的空气和呼出的气体的探究¶
五、排水集气法
-
用水装满集气瓶,用玻璃片盖住瓶口,瓶内不留气泡。
-
将装满水的集气瓶倒立在水槽中,将吸管伸入集气瓶口,吹气。
-
当瓶口有大气泡冒出时,表示气体收集已满,移出吸管,在水下盖好玻璃片。
-
将盖好的集气瓶移出水槽,正放在桌面上。
含量发生改变的:氧气(减少),二氧化碳(增多),水蒸气(增多)
U1-3 走进化学实验室¶
1.
可以作反应容器的玻璃仪器有:试管、烧杯、烧瓶、锥形瓶、集气瓶
🔥可以直接加热的容器:试管
❌不可以直接加热的容器:集气瓶、量筒

2.仪器介绍(教材P151-152)
U1-3-1 化学药品的取用¶
3.药品取用
-
三不原则:不用手拿、不直接用鼻闻、不用嘴尝。
-
节约原则:液体1-2mL、固体盖满试管底部。
-
处理原则:一般放入废物缸。
固体与液体的取用方法
(1)固体(盛放在广口瓶中)
-
块状(镊子):一横二放三慢竖
-
粉末(药匙/纸槽):一横二送三慢竖(送到底)
-
用托盘天平称量定量固体(需用称量纸,若有腐蚀性用小烧杯、表面皿):左物右码,\(m_物 = m_砝 + m_游\)
(2)液体(盛放在细口瓶中)
-
倾倒法:一倒二向三倾四紧挨
-
用量筒和胶头滴管量取一定量的液体:视线与凹液面最低处保持水平
-
使用滴管取少量液体药品:垂直悬空滴入、胶帽保持在上
实验1-4
-
澄清的石灰水中滴加酚酞溶液 现象:试剂变红
-
碳酸钠粉末与稀盐酸反应 现象:产生大量气泡
U1-3-2 物质的加热¶
酒精灯的使用(教材P21)
绝对禁止向燃着的酒精灯里添加酒精。
绝对禁止用酒精灯引燃另一只酒精灯。
- 熄灭酒精灯时,应该用灯帽盖灭(盖两次)。
(一定不要用嘴吹灭、用手指捏灭、用手指弹灭、用试卷打灭哦~) - 如果酒精洒出,在桌面上燃烧起来,不要惊慌,立即用湿抹布覆盖。
给试管中的物质加热
- 试管外壁应当保持干燥,试管内液体不超过试管容积的 \(\dfrac 1 3\) 。
- 试管架应该从试管底部套上、取下。夹在距离试管口\(\dfrac 1 3\) 位置处。
- 应先让试管底部均匀受热,然后再用外焰集中加热。
- 试管口不能对着人,防止液体暴沸溅出。
- 加热后的试管不能立即接触冷水。
U1-3-3 连接仪器装置¶
5.正确连接仪器装置
教材P22
实验1-7:检查装置的气密性
- 将装置组装好,将导管口伸入水面以下。
- 双手紧握试管壁,观察导管口有气泡冒出,则说明装置气密性良好。
U1-3-4 洗涤玻璃仪器¶
6.洗涤试管
教材P23
U2 我们周围的空气¶
U2-1 空气¶
U2-1-1 空气是由什么组成的¶
一、拉瓦锡测定空气成分
\(汞+氧气\xrightarrow{△(加热)}氧化汞\)
\(Hg+O_2\xrightarrow{△}HgO\)
\(氧化汞\xrightarrow{△}汞+氧气\)
\(HgO\xrightarrow{△}Hg+O_2\)
🧪实验2-1:实验室测定空气中氧气含量¶
二、实验室测定空气中氧气含量
1.原理:\(P+O_2\xrightarrow{点燃}P_2O_5\)
现象:①产生大量白烟②烧杯内的水回流到集气瓶,瓶内液体上升约\(\dfrac 1 5\)体积
⚠️瓶底水的作用:吸收有毒的物质(五氧化二磷),防止污染空气。
2.误差分析
- 小于\(\dfrac 1 5\):①装置漏气②红磷量不足③未冷却到室温就打开止水夹
- 大于\(\dfrac 1 5\):①红磷点燃后,未快速伸入集气瓶内②止水夹未夹紧
3.可代替红磷的药品:白磷、铜
\(Cu+O_2\xrightarrow{△}CuO(黑色固体)\)
条件①不能生成气体②能在空气中燃烧,消耗空气中氧气( \(Fe\) 不行)③不与空气中其它成分反应
三、空气的组成(体积分数)
\(N_2\) \(78\%\) ,\(O_2\) \(21\%\) ,\(CO_2\) \(0.03\%\) ,稀有气体 \(0.94\%\) ,杂质和其它 \(0.03\%.\)
四、纯净物与混合物
纯净物:①有化学式②与状态无关
如:液氧 \(O_2\) 、冰水混合物 \(H_2O\) 、铁水 \(Fe\) 、酒精 \(C_2H_5OH.\)
混合物:由两种及以上物质组成
如:纯净的空气、自来水、食盐、稀有气体、澄清石灰水、xx溶液、煤、石油、天然气、矿石、合金
U2-1-2 空气是一种宝贵的资源¶
五、空气中各成分用途
1、氧气:①医疗急救、供给呼吸②气焊气割(助燃化学性质)
2、氮气:①制造硝酸和氮肥(化学性质)②做保护气(化学性质)③冷冻麻醉,制造低温环境(物理性质)
3、稀有气体(惰性气体):作电光源、霓虹灯(物理性质)
U2-1-3 保护空气¶
六、保护空气
1.污染物:①有害气体:\(SO_2\)、\(NO_2\)、\(CO\)、\(O_3②\)烟尘(可吸入物颗粒物\(PM_{10}\)、细颗粒物\(PM_{2.5}\))
空气质量指数越高,空气质量级别越高,空气质量越差。
二氧化碳不是空气污染物。
2.三大环境问题
①全球气候变暖(冰川融化)
②酸雨( \(SO_2\)、 \(NO_2\) )
③臭氧层空洞(氟利昂等排放过多,会导致紫外线过强)
U2-2 氧气¶
一、氧气的物理性质
无色、无味、气体、密度大于空气,不易溶于水。
实验2-2:带火星的木条在氧气中的复燃
检验氧气的方法:将带火星的木条伸入集气瓶内。若木条复燃,则是氧气。
二、氧气的化学性质
实验2-3 硫在空气和氧气中的燃烧
1.硫 \(S\) (黄色固体)燃烧:
-
空气中①发出淡蓝色火焰②放热③生成有刺激性气味气体
-
氧气中①发出蓝紫色火焰②放热③生成有刺激性气味气体
\(S+O_2\xrightarrow{点燃}SO_2\)
瓶底水的作用:吸收有毒物质(二氧化硫),防止污染空气。
2.木炭 \(C\) (黑色固体)燃烧:
-
空气中①发出红光②放热③生成使澄清石灰水变浑浊的气体
-
氧气中①发出白光②放热③生成使澄清石灰水变浑浊的气体
\(C+O_2\xrightarrow{点燃}CO_2\)
缓慢伸入的目的:防止氧气受热散出。
实验2-4 铁丝在空气和氧气中的燃烧
3.铁丝 \(Fe\) (银白色固体)燃烧:
-
空气中①不燃烧
-
氧气中①剧烈燃烧,火星四射②放热③生成黑色固体
\(Fe+O_2\xrightarrow{点燃}Fe_3O_4(黑色固体)\)
4.镁 \(Mg\) 燃烧:
-
空气中:①发出耀眼白光②放热③生成白色固体
-
氧气中:更剧烈
\(Mg+O_2\xrightarrow{点燃}MgO\)
三、化合反应 P35(基本反应类型)
特点:多种物质反应生成一种物质。
四、氧化反应
1.物质跟氧(氧气/某些含氧物质)发生的反应
2.物质与氧气发生的反应一定是氧化反应
3.氧化反应不一定有氧气参与
4.氧化反应不是基本反应类型
U2-3 制取氧气¶
一、工业制取氧气(物理变化)
利用各物质沸点不同,分离液体空气(工业液氧:混合物)
二、实验室制取氧气
1.加热高锰酸钾(\(KMnO_4\))制取氧气
高锰酸钾:暗紫色固体
步骤:
-
查(检查气密性)
-
装(装药品,试管口放一团棉花)
-
定(固定装置时从左到右从下到上,试管口应略向下倾斜)
-
点(点燃酒精灯预热试管)
-
收(当气泡均匀冒出时,收集气体)
-
离(先将导管撤离水面)
-
熄(熄灭酒精灯)
-
拆(从右到左从上到下)
高锰酸钾分解v-t图

试管口放一团棉花:防止粉末进入导管
试管口略向下倾斜:防止冷凝水倒流炸裂试管
先离后熄:防止水槽内的水回流炸裂试管
2.过氧化氢分解制取氧气
过氧化氢:无色溶液
可代替二氧化锰的:硫酸铜、氧化铜、红砖粉末
步骤:
①查(检查装置气密性)
长颈漏斗型:关闭止水夹,向长颈漏斗内注水,一段时间后,长颈漏斗内页面不下降(或形成一段稳定水柱),证明不漏气。
连接注射器:拉动注射器,产生气泡;推动注射器,长颈漏斗内液面上升。则说明不漏气。
②装(装药品)
先固后液
③收集氧气(向上排空气法)
④验满氧气(将带火星的木条伸入集气瓶口,若木条复燃,则说明氧气已经收集满)
3.加热氯酸钾与二氧化锰的混合物制取氧气(试管口无棉花)
氯酸钾:白色固体
二氧化锰:黑色固体,难溶于水
氯酸钾分解v-t图:(略)
U2-3-3 制取装置的选择¶
制取装置¶
发生装置(由反应物状态和反应条件决定)¶
固体加热型、固液不加热型(长颈漏斗型[长颈漏斗下端管口要伸入液面以下,防止气体从长颈漏斗中逸出]、分液漏斗型[可控制反应速率、可用注射器代替])
收集装置(由气体的溶解性和密度决定)¶
排水法(不易溶于水、不与水反应,收集的气体较纯净,但不干燥)、向上排空气法(密度比空气大、不与空气成分反应,气体不纯净,但干燥)、向下排空气法(密度比空气小、不与空气成分反应,气体不纯净,但干燥)
三、分解反应(基本反应类型):一变多(见P39)
四、催化剂(P39)
U2-3-4 集气瓶(万能瓶)¶
1、向上排空气法
气体长进短出
2、向下排空气法
气体短进长出
3、排水法
瓶内装满水,气体短进长出
若长管处加量筒,可测量气体体积。
上方空气不影响测量
4、吸气除杂
气体长进短出
收集氧气不纯的原因
1、排水法时集气瓶内未装满水
2、未等气泡连续均匀冒出就开始收集
3、向上排空气法时导管没有伸到接近瓶底
U3 物质构成的奥秘¶
U3-1 分子和原子¶
U3-1-1 物质由微观粒子构成¶
一、分子是真实存在的,物质是由微粒(原子、分子、粒子)构成的
二、分子的基本性质
1、分子的体积、质量都很小。
2、分子在不断运动,温度越高分子运动越快。
3、分子间有间隔(\(气体>液体>固体\))
热胀冷缩:分子间隔改变,分子本身体积不变
4、分子相同,化学性质相同。分子保持物质的化学性质。
分子的性质对原子同样适用
U3-1-2 分子可以分为原子¶
一、分子是由原子构成的
1、分子是保持物质化学性质的最小微粒
2、原子是化学变化中的最小的粒子
3、分子与原子的本质区别:在化学变化中,分子可再分,原子不可分。
二、
物理变化:没有新分子生成的变化
化学变化:有新分子生成的变化
三、化学变化的实质:分子分裂成原子、原子又重新组合成新分子
四、由原子直接构成的物质:
①所有的金属单质:\(Fe\)铁、\(Mg\)镁、\(Hg\)汞、\(Cu\)铜、\(Ag\)银、\(Au\)金、\(Pt\)铂
②稀有气体:\(He\)氦、\(Ne\)氖、\(Ar\)氩
③部分非金属单质:\(C\)碳、\(P\)磷、\(S\)硫、\(Si\)硅
五、纯净物和混合物的微观解释
由一种分子构成的是纯净物(纯净物不一定由一种“分子”构成)
由多种分子构成的是混合物(混合物不一定由多种“分子”构成)
U3-2 原子的构成¶
U3-2-1 原子的结构¶
一、原子(不显电)
原子核
核外电子
①核电荷数=质子数=核外电子数=原子序数
②质子数不一定等于中子数
③不是所有的原子都有中子(氢原子没有中子)
④不同原子,质子数不同(质子数决定了原子的种类)
⑤整个原子不显电性
⑥原子的质量主要集中在原子核(即质子、中子的质量和,电子质量忽略不计)
二、相对原子质量
1、定义P56
\(Ar=\frac{m}{(m_{(c)}\times \frac{1}{12})}\) 【比值定义法,单位1】
⚠️注:Ar越大,该原子的质量就越大
2、推理公式
相对原子质量=质子数+中子数
U3-2-2 原子核外电子的排布¶
一、分层排布
原子层 1 2 3 4 5 6 7
原子核 近---------->远
能量 低---------->高
二、原子结构示意图
三、核外电子排布规律
(1)第一层最多排2个
(2)第二层最多排8个
(3)第三层最多排\(2n^2\)个
(4)最外层最多8个
(1-20号排布规律:2-8-8)
四、原子结构与化学性质的关系
【结论1】原子的最外层电子数决定了化学性质
【结论2】一般来说,最外层电子数相等的原子,化学性质相似
【结论3】质子数决定元素种类
U3-2-3 离子¶
一、离子
1、定义:带电的原子或原子团
2、形成:原子得失电子形成
金属原子——失去电子——阳离子
非金属原子——得到电子——阴离子
(特例:氢原子失去一个电子,形成氢离子\(H^+\))
具有相对稳定结构的粒子:①稀有气体原子②离子
3、书写:在右上角先写数字(1省略),再标正负号
4、离子符号的意义:
5、常见原子的离子符号


二、离子化合物
1、构成:由阴阳离子构成,对外不显电;
2、组成:金属元素+非金属元素(特例:氧化汞由分子构成)
三、物质由原子、分子、离子构成:
(1)由原子构成的物质
①所有金属单质②稀有气体③部分非金属单质
(2)由离子构成的物质:离子化合物(金属元素+非金属元素)
\(CuSO_4\):\(Cu^{2+}\)和\(SO_4^{2-}\)
\(NaCl\):\(Na^+\)和\(Cl^-\)
\(KMnO_4\):\(K^+\)和\(MnO_4^-\)
(3)由分子构成的物质:除(1)(2)外所有物质
U3-3 元素¶
U3-3-1 元素¶
一、定义:元素是质子数相同的一类原子的总称
①质子数决定元素种类,不同元素质子数不同
②元素的种类与其是否带电无关
③同种元素的原子可以有很多种
④质子数相同的粒子不一定是同种元素(如:\(Ne\)、\(H_2O\)、\(NH_3\)、\(CH_4\)质子数都是10)
二、特点
①元素只讲种类,不讲个数
化学反应前后,元素种类不变。
三、元素含量
(1)地壳中:\(O\) \(Si\) \(Al\) \(Fe\) \(Ca\)
(2)空气中:\(N\) \(O\)
(3)生物细胞中:\(O\) \(C\) \(H\) \(N\) \(Ca\)
U3-3-2 元素符号¶
一、采用拉丁文首字母,大写
二、元素符号的意义
①宏观上,表示该种元素
②微观上,表示一个该原子
注1:由原子直接构成的物质,元素符号有三层含义(③表示该物质)
注2:化学符号前有数字时,只表示微粒个数
U3-3-3 元素周期表简介¶
一、编排依据:元素的性质随着原子序数的递增而呈周期性的变化
二、编排结构
横行——周期(7个横行7个周期)
纵列——族(18纵列16个族)
三、排列规则
(1)同一周期元素的原子电子层数相同,最外层电子数从左至右依次递增
(2)同一族最外层电子数相同,化学性质相似,电子层数依次递增
U4 自然界的水¶
U4-1 爱护水资源¶
教材 P68-73
U4-2 水的净化¶
一、分类
纯水:\(H_2O\)、水蒸气、蒸馏水、冰水混合物(纯净物)
天然水:可溶性杂质(色素、异味、钙镁离子)、不溶性杂质(泥沙等)
二、实验室常用净水方法
1、沉淀
①静置沉淀
②吸附沉淀:加入明矾,明矾溶于水生成胶状物吸附杂质
2、过滤:分离不溶性固体和液体(除去不溶性杂质)
过滤需要用到的玻璃仪器:玻璃棒、漏斗、烧杯
玻璃棒的作用:引流
一贴:
滤纸紧贴漏斗内壁
二低:
滤纸边缘低于漏斗边缘
液面边缘低于滤纸边缘
三靠:
烧杯口紧靠玻璃棒
玻璃杯斜靠三层滤纸一边
漏斗下端紧靠烧杯内壁
⚠️浑浊的原因:①滤纸破损②液面高于滤纸边缘③仪器不干净
⚠️过滤慢的原因:①过滤前未静置,固体杂质堵住滤纸孔②滤纸未紧贴漏斗内壁,之间留有气泡
3、吸附:木炭、活性炭(表面疏松多孔)
4、蒸馏:冷凝管的水下进上出(充分冷却)
蒸馏烧瓶中放几粒沸石:防止液体暴沸。
三、自来水厂的净水步骤
沉淀(加明矾)——过滤——吸附——投药消毒
四、硬水和软水
1、硬水:含有较多可溶性钙镁化合物的水。
软水:不含/少含
2、检验方法
①取样于试管②加入等量肥皂水,震荡
若泡沫多——软水
若浮渣多——硬水
3、硬水软化方法
生活中:煮沸
实验室:蒸馏
U4-3 水的组成¶
一、氢气的物理性质
无色无味,密度比空气小,难溶于水
二、探究水的组成
1、生成水的途径
原理:\(氢气+氧气\xrightarrow{点燃}水\)
\(H_2+O_2\xrightarrow{点燃}H_2O\)
现象:①产生淡蓝色火焰②放热③干冷烧杯内壁出现水雾
结论:水由氢元素和氧元素组成
氢气具有可燃性,使用前要验纯
2、电解水的途径
(1)实验目的:探究水的组成
(2)操作注意:向水中加入氢氧化钠溶液,增强水的导电性。
(3)实验现象:\(V_{(正极)}:V_{(负极)}=1:2\)
(4)实验原理:\(H_2O\xrightarrow{通电}H_2+O_2\)
(5)实验结论:水由氢元素和氧元素组成
(6)误差分析氧气和氢气的比例小于\(1:2\):①氧气不易溶于水,氢气难溶于水②氧气可能与金属电极发生反应
三、物质的分类
物质:
纯净物:
单质:\(N_2\) \(O_2\) \(O_3\) \(H_2\) \(He\) \(Ne\) \(Ar\)
化合物
氧化物
其他:酸、碱、盐(\(KMnO_4\))
混合物:
由一种元素组成的物质不一定是单质(如\(O_2\)、\(O_3\))
U4-4 化学式与化合价¶
U4-4-1 化学式¶
一、化学式的定义
用元素符号和数字的组合表示物质组成的式子叫做化学式(教材P83)
⚠️一种化学式不一定只表示一种物质(红磷/白磷)(金刚石/石墨)
二、化学式的意义
(1)由分子构成的物质
化学式:①表示该物质②表示该物质的元素组成(宏观)③表示一个该分子④表示1个分子的原子构成(微观)
(2)由原子构成的物质
化学式:①表示该物质②表示该元素(宏观)③表示一个原子(微观)
(3)由离子构成的物质
化学式:①表示该物质②表示该物质的元素组成(宏观)③表示该物质中各元素离子个数的最简比
三、化学式周围数字的意义
1、化学式中元素符号右下角的数字表示每个分子中的原子个数
2、化学式前面的数字表示分子个数。只具有微观意义。
\(5Cl_2\)(五个氯分子、每个氯分子由两个氯原子构成) / \(5Cl\)(五个氯原子)
四、化学式的读法和写法
化合物写法的基本原则:金氢左,非金右。氧化物中氧在后。
化合物读法的基本原则:从右往左读。
“某化某”
“某酸某”:酸根离子与金属离子形成
“某酸”:酸根离子与H形成
“氢氧化某”:\(OH\)与金属离子形成
⚠️注:金属呈低价时,读作“某化亚某”
常见元素和原子团的化合价口诀¶
\(H\) \(Na\) \(K\) \(Ag\) \(+1\)价
\(Ca\) \(Mg\) \(Ba\) \(Zn\) \(+2\)价
\(F\) \(Cl\) \(Br\) \(I\) \(-1\)价
通常\(O\)为\(-2\)价
\(Al\) \(+3\) 来,\(Si +4\)
C\(有\)+2和+4
+2+3\(Fe\)常有
+1+2\(Cu\)也有
\(S\)有-2+4和+6
负一氢氧(\(OH\))硝酸(\(NO_3\))根
负二硫酸(\(SO_4\))碳酸(\(CO_3\))根
负三价有磷酸(\(PO_3\))根
正一记住是铵(\(NH_4\))根
U4-4-2 化合价¶
一、定义:元素化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子之间互相化合的数目。
二、实质:由最外层电子数决定。失去N个电子显正N价,得到N个电子显负N价。
三、表示方法(“1”不能省略,要写“+” “-”)
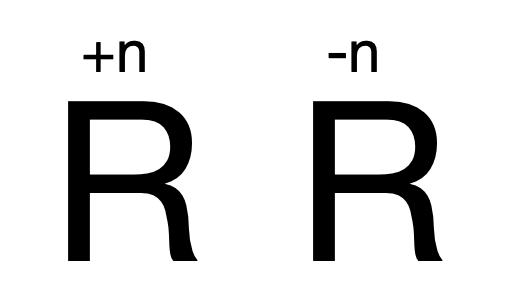
四、意义:某物质中某元素化合价为某价
五、化合价的一般规律
①在单质里,元素的化合价为0
②在化合物里,元素化合价有正有负,且代数和为0。
③氧元素通常显-2价,氢元素通常显+1价(过氧化物中氧为-1价,金属的氢化物中氢为-1价)
④在离子化合物中,金属元素通常显正价,非金属元素显负价。
⑤一些元素在不同物质中可显不同的化合价
⑥在同一物质里,同一元素也可以显不同的化合价 例如: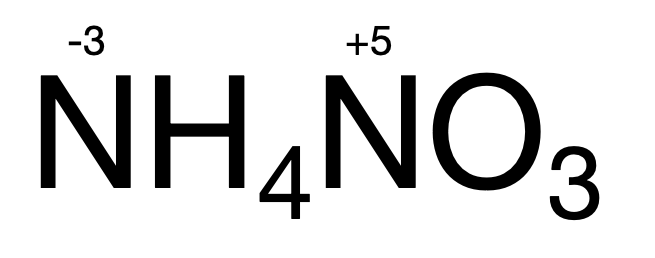
⑦在原子团中,各元素化合价的代数和为该原子团的化合价且不等于0
六、化合价的运用
1、根据化合价书写离子符号
2、根据化学式求化合价
根据①化合物中正负代数和为0
②原子团中各元素化合价代数和等于原子团的化合价,且不等于0
3、根据化合价求化学式
方法:①最小公倍数法②十字交叉法
⚠️注1:原子团看成整体,两个及以上需要打括号
⚠️注2:与金属元素一起时,Cl一般显-1价,S一般显-2价
⚠️注3:+2价\(Fe\)读为亚铁,+3价\(Fe\)读为铁
⚠️注4:某某铵中,铵是\(NH_4^+\)
⚠️注5:化合价数字前必须要有正负号
\(Fe_2O_3\)
\(SO_3\)
\(Na_2SO_4\)
U4-4-3 有关化学式的计算¶
类型一:计算相对分子质量
符号Mr,单位“1”
解:\(Mr_{(H_2O)}=1\times2+16=18\)
类型二:求化合物中各元素的质量比
解:在\(H_2O\)中,\(m_{(H)}:M_{(O)}=(1\times2):16=1:8\)
类型三:计算物质中某元素的质量分数(保留一位小数)
解:在\(H_2O\)中,\(H\%=(1\times2)/18=11.1\%\)
在\(A_mB_n\)中,\(A\%=\frac{m_{(A)}}{m_{(A_mB_n)}}\times100\%=\frac{Ar_{(A)}}{Mr_{(A_mB_n)}}\times100\%\)
类型四:已知化合物的质量求某元素的质量
已知\(m_{(H_2O)}=1.8kg\),则\(m_{(H)}=\frac{1.8kg\times2}{18}\times100\%\)
类型五:已知某元素的质量求化合物的质量
已知\(H_2O\)中\(m_{(H)}=0.2kg\),\(m_{(H_2O)}=\frac{0.2kg}{(\frac{2}{18}\times100\%)}=1.8kg\)
类型六:混合物中某纯净物的质量分数
\(纯度=\frac{m_{(纯净物)}}{m_{(混合物)}}\times100\%\)
例:大理石中,\(CaCO_3\%=\frac{900kg}{1000kg}\times100\%=90\%\)
U5 化学方程式¶
U5-1 质量守恒定律¶
U5-1-1 质量守恒定律¶
一、实验探究
①\(P+O_2\xrightarrow{}P_2O_5\)
②\(Fe+CuSO_4\xrightarrow{}Cu+FeSO_4\)
二、质量守恒定律(P84)
1、注意:
①参加:指有剩余的物质不能计算在内
②质量总和
③化学反应
2、质量守恒定律的实质
①原子种类(元素种类)不变
②原子数目(元素质量)不变
③原子质量(物质的质量)不变
①分子的种类(物质的种类)改变
①分子数目(元素的化合价)可能改变
在证明质量守恒定律时,当有气体参加或生成的化学反应,一定要在密闭容器中进行。
一切化学反应均遵循质量守恒定律。
U5-1-2 质量守恒定律的应用¶
一、根据质量守恒定律,求某物质的质量
①恰好反应:是指物质都反应完,没有剩余
②充分反映=完全反应:指至少有一种物质被反应完,反应停止(可能有剩余)
U5-1-3 化学方程式¶
一、化学方程式的读法
①宏观读法:“+”读作“和”,“\(=\)”读作“反应生成”
②质量读法:\(n\times Mr\),比值不化简
③微粒读法:每几个某分子和几个某分子在xx条件下反应生成几个某分子
U5-2 如何正确书写化学方程式¶
一、化学方程式的书写步骤
1、写
2、配
3、注条件
4、标暗箭 (“无中生有才放箭”)
二、配平的方法
1、令“1”法
注:有原子团时,先配平原子团
2、得失氧法(适用于\(CO\)与金属氧化物的反应方程式的配平)
一氧化碳前面的计量数与金属氧化物中氧原子的个数相等
U5-3 利用化学方程式的简单计算¶

U6 碳和碳的氧化物¶
U6-1 金刚石、石墨和\(C_{60}\)¶
U6-1-1 金刚石、石墨、\(C_{60}\)¶
一、金刚石、石墨、\(C_{60}\)是不同的碳单质
| 名称 | 化学式 | 结构 | 物理性质 | 用途 |
|---|---|---|---|---|
| 金刚石 | \(C\) | 框架式 | 坚硬 | 切割、作钻头 |
| 石墨 | \(C\) | 层叠状 | 质地软、有滑感、导电性能好 | 作电极、铅笔芯 |
| \(C_{60}\) | \(C_{60}\) | 足球状 | / | 新型催化剂 |
物理性质差异大的原因:碳原子的排列方式不同
石墨转换为金刚石属于化学变化
二、无定形碳(主要含有石墨)
1、木炭
2、活性炭
3、炭黑:制墨水
U6-1-2 碳单质的化学性质¶
一、常温下的稳定性
由最外层电子数(4)决定
二、可燃性
\(C + O_2 =点燃= CO_2(氧气充足)\)
\(2C + O_2 =点燃= 2CO(氧气不充足)\)
三、还原性
\(C + 2CuO =高温= 2Cu + CO_2\uparrow (置换反应)\)
现象①黑色粉末变红②澄清石灰水变浑浊
碳(\(C\))作还原剂,夺取氧,发生氧化反应,具有还原性
氧化铜(\(CuO\))作氧化剂,失去氧,发生还原反应,具有氧化性
⚠️①氧化-还原反应同时进行,不是基本反应类型
②氧化剂被还原,还原剂被氧化。
U6-2 二氧化碳的制取¶
一、药品的选择
- 碳酸钠粉末与稀硫酸溶液反应(粉末反应太快,不方便收集)
$$ Na_2CO_3+2HCL=2NaCl+H_2O + CO_2\uparrow $$
-
大理石和稀硫酸溶液反应(生成微溶于水的硫酸钙,覆盖在固体表面,阻止反应的进行) $$ CaCO_3+H_2SO_4 = CaSO_4+H_2O+CO_2\uparrow $$
-
大理石和稀盐酸溶液反应(不能用浓盐酸溶液,会挥发出氯化氢气体,使二氧化碳不纯。
二、制取装置
发生装置:固液不加热型
收集装置:只能用向上排空气法(\(CO_2\)和水反应生成\(H_2CO_3\)碳酸)
三、实验室制取二氧化碳的步骤
- 查
- 加(先固后液)
- 收
- 验满二氧化碳:将燃着的木条放在集气瓶口,若木条熄灭,则\(CO_2\)已满
补充:检验\(CO_2\):通入澄清石灰水,若变浑浊,则为\(CO_2\)
原理: $$ CO_2+Ca(OH)_2=CaCO_3↓+H_2O $$ 有孔塑料隔板优点:可控制反应的发生和停止
条件:用于块状固液不加热型,粉末不可以🙅
四、工业制二氧化碳(高温煅烧石灰石)
U6-3-1 二氧化碳的性质¶
无色无味的气体,密度比空气大。能溶于水。
固体二氧化碳叫干冰,能溶于水
二、\(CO_2\)的化学性质
1、不能燃烧,也不支持燃烧
2、\(CO_2\)不能供给呼吸(灯火实验)
3、\(CO_2+H_2O=H_2CO_3\) \(H_2CO_3=H_2O+CO_2\)
4、\(CO_2+Ca(OH)_2=CaCO_3+H_2O\)
5、弱氧化性
U6-3-2 \(CO\)的性质¶
一、\(CO\)的物理性质
无色无味的气体,密度比空气略小
二、\(CO\)的化学性质
- 可燃性→作燃料(使用前需要验纯)
\(2CO+O_2=点燃=2CO_2\)
- 毒性
一氧化碳和血红蛋白的结合能力是氧气的200~300倍
如若空气中的一氧化碳体积分数达到0.02%,人在其中2~3h
- 还原性
\(CO+CuO==Cu+CO_2\)
现象:①黑色粉末变红②澄清石灰水变浑浊
步骤:
一通:先通一氧化碳
二点:后点燃酒精灯加热
三灭:先熄灭酒精灯
四停:等到冷却后再停止通\(CO\)